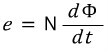탁도의 표준단위 및 측정방법
탁도는 물의 흐린 정도를 정량적으로 나타낸 지표로서 현재 학계에서 사용되고 있는 탁도의 단위는 표 3-1과 같으며, 여러 가지 탁도 단위들의 환산표는 표 3-2에
정리하였다. 이들 단위를 사용하는 측정기는 표준 부유물로 교정하여야 하며, 국제적으로 인정된 탁도 표준은 포르마진(Formazine) 이다.
또한, 순수 용액에는 미립자가 없으나, 이상적인 순수 용액은 없고 정제수가 약 0.023 NTU에 해당된다.
| 단 위 | 내 용 |
| NTU (Nephelometric Turbidity Unit) |
Nephelometer를 사용하여 탁도를 측정하는 단위를 말함. 산란광과 탁도(계량화된량)간의 관계를 나타내기 위해 산란광의 측정은 입사광 의 90도에서 이루어진다. * 먹는물 기준 (1999년 2월 11일개정)은 탁도를 NTU 단위로 측정 하여 수질기준을 1NTU 이하로 할 것을 규정하고 있음. [먹는물 수질공정시험방법(2002.6.21고시,환경부) 탁도측정방법] |
| PPM (Parts Per Million) |
Kaolin 표준탁도 : 극소 함유량의 단위로 ppm을 도(˚)로도 사용한다. 도는 카오린으로 표준화한 광전분광광도계, 광전광도계로 측정하는 측정 단위임. |
| FTU (Formazin Turbidity Unit) |
포르마진 탁도 단위로 적외선 광원을 채택한 Nephelometer를 사 용하여 탁도를 측정한다. |
| FAU (Formazine Atenuation Units) |
수처리에서 사용하는 포르마진 광량감쇠단위로 주로 0°산란각에서 측정한 값으로 ISO 7027에 의한다 |
| FNU (Formazine Nephelometric Units) |
수처리에서 사용하는 포르마진 네펠로메트릭 단위로 주로 90°산란각 에서 측정한 값으로 ISO 7027에 의한다. |
| ASBC (American Society of Brewing Chemist) |
미국 양조화학자 협회 단위 |
| JTU (Jackson Turbidity Unit) |
잭슨 탁도 단위계로 측정하였을 경우 사용하는 단위임. 눈금 있는 Mass-Cylinder를 촛불 위에 올려놓은 상태에서 Mass-Cylinder에 액체를 넣게 되면 탁도에 따라서 불꽃이 보이는 눈금이 달라지는 원리를 이용한다. 일반적으로 육안법으로 구한 결과와 기기법에서 Formazin 표준을 사용하면 40 JTU가 40 NTU와 거의 같아진다. (American Water Works Association Research Foundation, 1998) |
| EBC (European Brewery Convention) |
유럽양조협회 단위 |
| TE/F (Tribungseinheit/Formazine) |
독일 포르마진 탁도단위로 현재는 FNU로 대체되었다. |
탁도 단위 환산표
| 구분 | 1 FNU, 1 NTU, 1 FTU | 1 ASBC | 1 EBC |
| FNU, NTU, FTU | 1 | 0.057 | 4 |
| ASBC | 17.5 | 1 | 70 |
| EBC | 0.25 | 0.014 | 1 |
측정 방법
탁도 측정방법은 기기분석법과 육안법이 있다. 기기분석법은 혼탁입자들에 의하여 산란도를 측정하는 네펠로법(Nephelometry)을 이용하는 것으로 네펠로법-
혼탁도-단위(Nephelometry Turbidity Unit ; NTU)를 사용한다. 육안법은 혼탁도에 의하여 빛의 통과가 방해받는 정도를 측정하는 방법으로 젝슨-혼탁도-단위
(Jackson Turbidity Unit ; JTU)를 사용한다. 이와 같이 측정하는 방법이 근본적으로 다르므로, 기기 분석법에 의한 측정결과와 육안법에 의한 측정결과에는 약간의 차이가 나타나게 되며, 그 정도는 혼탁입자들의 특성에 따라 달라진다.
| 분석법 | 범위 | ||
| 네펠로법(Nephelometry) | 저농도 | ||
| 네펠로법(Nephelometry) | 고농도 | ||
| Jackson candle turbidimeter | 100 ~ 1000 (짧은 관) JTU | ||
| Jackson candle turbidimeter | 25 ~ 1000 (긴 관) JTU | ||
| 병표준법(Bottle standard) -음용수 수질검사방법 | 5 ~ 100 도(mg/ℓ) | ||
'수질관련용어' 카테고리의 다른 글
| 제어 시스템 종류 및 설명 및 Controller의 제어방식 (0) | 2022.11.08 |
|---|---|
| 탁도의 표준시약 제조방법 (0) | 2022.11.08 |
| 먹는물 수질기준 항목은? (1) | 2022.11.08 |
| 장마철 누전 브레이커는 테스트 버튼으로 고장체크 (0) | 2022.11.08 |
| pH 전극 사용 및 관리방법 (0) | 2022.11.08 |