물의 경도(Water Hardness) 란?
경수는 일반적으로 비누 및 세제의 작용을 방해하고, 보일러나 heater 등의 배관에 scale을 형성하는 등 일상 생활과 산업활동에 많은 장해를
일으킨다. 그래서 많은 노력과 경비가 필요 이상으로 소모되는 경우가 있다. 최근에는 종합세제의 개발로 경수에서도 세척력을 충분히 발휘할 수
있는 제품이 나와 이러한 문제는 거의 해결되었다.
그러나 배관 및 기타 물을 사용하는 곳에서의 scale 형성은 아직도 그 문제가 완벽히 해결되지 않았다.
경도는 물 속에 포함되어 있는 경도성분의 농도에 따라 다음과 같이 분류 할 수 있다.
| ppm as CaCO3 | 경 도 |
| 0 ~ 75 | Soft |
| 75 ~ 150 | Moderately hard |
| 150 ~ 300 | Hard |
| 300 이상 | Very hard |
1. 경도의 정의
경도는 수중의 +2가 양이온금속에 의해 발생한다. 그 대표적인 물질로 Ca+2와 Mg+2를 들 수 있으며 그 외에 Sr+2, Fe+2, Mn+2 등을 들 수 있다. 이러한 이온들은 비누나 세제의 작용을 방해하고 특정 음이온이 존재할 경우 scale을 형성한다. 경도 유발물질과 주요 결합 음이온은 다음 표와 같다.
| 경도유발 양이온 | 음이온 |
| Ca+2 | HCO3- |
| Mg+2 | SO4-2 |
| Sr+2 | Cl- |
| Fe+2 | NO3- |
| Mn+2 | SiO3-2 |
대부분의 경도는 토양과 암석으로부터 유발된다. 비가 내리면 그 빗물은 땅속으로 스며들게 되고 그 과정에서 빗물에는 토양 미생물의 활동에 의해 생성된 CO2가 녹아들게 된다. 그렇게 되면 물은 산성을 띄게 되고 그 물은 토양이나 암석 등과 접촉하며 양이온 금속들이 녹아들게 된다.
2. 경도의 결정
경도는 보통 CaCO3로 환산한 값을 기준으로 한다. 경도를 결정하는 방법으로는 계산에 의한 방법과 EDTA(EthyleneDiamineTetraaceticAcid)로 적정하는 방법을 사용한다.
1) 계산법
물속의 +2가 양이온 금속이온의 농도를 측정해 그 값을 CaCO3의 양으로 환산하여 경도를 결정한다.
그 계산방법은 다음과 같다.
경도 as CaCO3 = M+2(ppm) x 50/(M+2의 당량(wt)) ∴ M+2 : +2가 양이온금속
예를들어 수질분석 결과가 다음과 같다고 할 때 경도를 계산해 보면 다음과 같다.
| 양이온 | ppm | 음이온 | ppm |
| Na+ | 20 | Cl- | 40 |
| Ca+2 | 15 | SO4-2 | 16 |
| Mg+2 | 10 | NO3-1 | 1 |
| Sr+2 | 2 | 알칼리도 | 50 |
| 양이온 | 당 량 (wt) | 경 도 (ppm as CaCO3) |
| Ca+2 | 20 | 15 × 50 ÷ 20.0 = 37.5 |
| Mg+2 | 12 | 10 × 50 ÷ 12.2 = 41.0 |
| Sr+2 | 43.8 | 2 × 50 ÷ 43.8 = 2.3 |
| 총 경 도 | 80.8 | |
2) EDTA 적정법
이 방법은 EDTA 용액이나 그 Na염을 이용해 적정을 하는 방법이다.
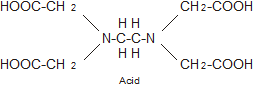
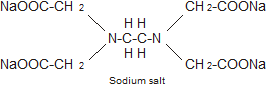
이러한 화합물은 일반적으로 EDTA로 표현되며 Ca+2, Mg+2과 안정한 화합물을 형성한다.
M+2 + EDTA → [M․EDTA] complex
EDTA를 이용하여 완벽하게 경도를 측정하려면 EDTA의 양을 측정할 수 있는 지시약이 필요하다. 보통 Eriochrome Black T라 하는 염료가 사용되는데 파란색을 띄고 있으며 경도성분이 포함된 pH10정도의 물에 혼합되면 Ca+2, Mg+2와 약하게 결합하며 붉은 빛을 띄게 된다.
M+2 + Eriochrome Black T → M․Eriochrome Black T (붉은색 화합물)
EDTA로 적정을 하게되면 모든 경도유발 물질은 EDTA와 반응하여 더 안정한 화합물을 형성하게 된다. 이 반응은 Eriochrome Black T의 파란색이 붉은색으로 바뀌는 시점에서 그 반응의 완료를 확인할 수 있다.
3. 경도의 종류
총경도는 경우에 따라 경도의 존재형태를 확인해야 할 필요가 있다. 경도는 다음 두 가지로 분류할 수 있는데, 첫 번째는 금속이온에 의한 것이고 두 번째는 금속이온과 음이온이 결합되어 있는 형태이다.
1) Ca+2, Mg+2 경도
Ca+2, Mg+2은 자연수의 경도유발물질 중 가장 많은 부분을 차지하고 있다. 따라서 Ca+2, Mg+2의 양을 측정하는 것은 경도 측정에 있어 중요한 일이다. 예를들어 Mg+2의 경우 lime-soda ash를 이용해 연수화를 할 경우 Mg+2의 존재양은 필요한 lime-soda ash의 양을 결정하는 중요한 요소가 된다.
만약 총경도가 Ca+2, Mg+2에 의해서만 형성되었다고 하면 총경도에서 Ca+2에 의한 경도를 빼면 Mg+2 에 의한 경도가 될 것이다.
총 경도 - Ca+2 경도 = Mg+2 경도
2) 탄산염(Carbonate), 비탄산염(Noncarbonate) 경도
총경도를 구성하는 물질이 중탄산염 그리고 탄산염 알칼리도와 동등한 수준일 경우 총경도는 탄산염에 의한 경도로 생각할 수 있다. 알칼리도와 경도는 CaCO3의 양으로 환산하여 비교하면 다음과 같은 관계를 알 수 있다.
* 알칼리도 < 총 경도 : 탄산염 경도 (ppm) = 알칼리도 (ppm)
* 알칼리도 ≥ 총 경도 : 탄산염 경도 (ppm) = 총 경도 (ppm)
탄산염 경도는 보일러 등과 같이 온도가 높은 곳이나 또는 lime에 의한 연수화 과정에서 침전을 형성한다.
Ca+2 + 2HCO3- → CaCO3 + CO2↓ + H2O
Ca+2 + 2HCO3- + Ca(OH)2 → 2CaCO3↓ + 2H2O
탄산염 경도는 일반적으로 일시경도(Temporary hardness)라 부르는데 그 이유는 위에서와 같이 가열방법으로 비교적 쉽게 제거할 수 있기 때문이다.
총경도는 상기 탄산염 경도 이외에 다른 경보성분이 포함되어 있다. 즉 탄산염 경도 이외의 경도를 비탄산염 경도(noncarbonate hardness)라 한다.
비탄산염 경도 = 총 경도 - 탄산염 경도
상기에서 본 바와 같이 경도는 물론 알칼리도는 CaCO3로 환산하여 표시할 수 있으며, 경도와 알칼리도는 서로 관계가 있음을 알 수 있다. 비탄산염 경도는 보통 영구경도(permanent hardness)라고 표현하는데 탄산염 경도와 같이 가열방법으로는 제거되지 않기 때문이다. 비탄산염 경도유발 양이온은 sulfate, chloride, nitrate 와 같은 음이온과 결합되어 있는 경우이다.
3) 유사경도 (Pseudo Hardness)
바닷물 및 기타 Na+가 많이 포함되어 있는 물에서는 일반적으로 비누의 작용이 원활하지 못하다. 그 이유는 공통이온효과 때문이다. Na+는 경도를 유발하는 이온은 아니지만 다량 포함되어 있을 경우 경도와 유사한 효과를 가져온다.
'수질관련용어' 카테고리의 다른 글
| 입자의 응집 이론 및 단독입자의 침강 (0) | 2022.11.09 |
|---|---|
| BOD 측정을 위한 희석율 (0) | 2022.11.08 |
| 수질 측정장비나 기타 측정기기의 RS485에 대한 설명 (0) | 2022.11.08 |
| 수질 측정장비나 기타 측정기기의 RS422에 대한 설명 (0) | 2022.11.08 |
| 수질 측정장비나 기타 측정기기의 RS232에 대한 설명 (0) | 2022.11.08 |