| 항 목 |
기 준 |
시험방법 |
특 성 |
발생원 |
인체영향 |
제거법 |
| 염소이온 (Cl-) |
150㎎/ℓ
이하 |
적정법
(이온크로마토그라피(I.C)) |
할로겐족 원소의 하나.
일반적으로 염화나트륨(NaCl), 염화칼륨(KCl),염화칼슘(CaCl2) 의 형태로 존재
자연환경중에 해양에 염화물이 가장 많이 존재함.
물의 오염지표로 사용 |
해변가의 해수 침 투, 생활하수, 분 뇨의 침출수, 도로 의 제설작업, 화학 공장폐수등 |
염화물은 인간의 체내에서 가장 풍부한 음 이온이며 양이온들과 결합하여 세포외액의 삼투작용에 기여.
염화물의 90~95%는 소변으로 배설.
4~8%는 분변으로, 약 2%는 땀으로 배설. 촵염소이온이 약 250㎎/ℓ이상이면 물에서 맛을 느낄 수 있으나 역치값은 결합한 양 이온에 달려있다.
생체에 미치는 염소이온 독성은 관찰된 바 없고 건겅한 사람은 물을 통한 과다섭취를 견딜 수 있다.
|
역삼투압법
이온교환법 |
| 증발잔류물 |
500㎎/ℓ
이하 |
증발건조법 |
검수를 증발건조할 때 잔류하는 물질로 물의 함유 물질량(용존산 소나 저비점물질등은 제외)을 나 타냄.
촵일반적으로Ca2+,Mg2+,Na+,K+,Cl-, SO42-,HCO-,SiO2
등의 미네랄의 함유량을 표시. |
분석항목임. |
건강에 직접적으로 해를 끼치기보다는 심 미적인 영향을 줌. |
이온교환수지법
흡착법 |
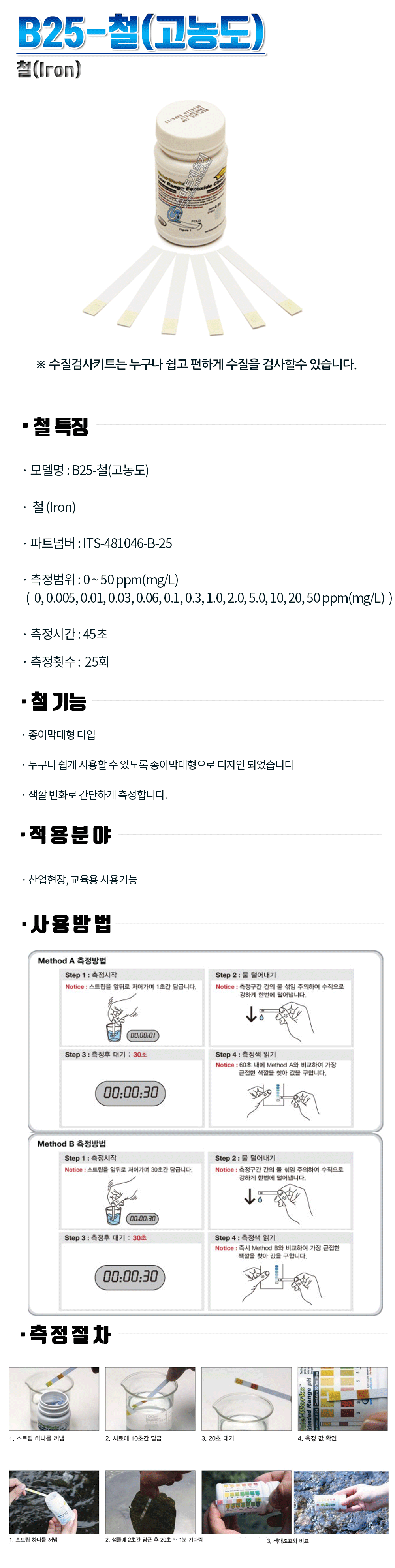
| 철(Fe) |
0.3㎎/ℓ
이하 |
흡광광도법
(원자흡광광도 법) |
지구상에서 4번째로 풍부한 원소
물속에서는 주로2가와 3가상태 로 존재, 지표수에서는 제2철 염 상태로 존재.
지하수, 호수, 저수지및 황화물, 탄산염등이 없는 상태에서는 고 농도의 용해성 제1철이 존재. |
암석과 광물의 용 해, 토질 침출물, 광산의 배수 및 철 관련공장의 폐 수, 하수.
수도관에서 녹아 나옴. |
철을 과다하게 섭취하면 혈색증.
불쾌한 맛이 나고, 철 세균의 성장을 촉진 시킨다.
주철관과 강관의 부식은 배수관망에 적수 문제를 일으킴. |
산화법 : 공기,염소 과망간산칼륨으로 3 가, 4가로 산화후 침 전, 여과시킴
접촉산화법 : 망간 제오라이트를 사용
석회-소다회법:경도제거방법을 이용
수산화물 침전 |
| 망간(Mn) |
0.3㎎/ℓ
이하 |
원자흡광광도법 |
자연상태로는 주로 철화합물과 결합하여 여러 염과 광물질로 발견.
CO2를 포함하고 있는 물속에서 는 극히 비용해성.
혐기성 상태에서 2산화물인 망 간이 4가에서 2가로 환원. |
관련 산업폐수: 건 전지제조,제강업,가 죽업,도자기제조업
지하수와 호수, 저 수지등에서 수온성 층시 저니중의 망 간이 환원상태로 용출됨. |
0.05㎎/ℓ이상 : 간장과 신장에 축적, 신경장애 를 초래.
가축의 경우 : 부족하면 생식능력 감소, 성장부진.
0.15㎎/ℓ이상인 물 : 불쾌한 맛, 세탁물을 얼룩지게 함.
망간의 도움으로 유해한 미생물이 증식하여 물에 맛과 냄새를 유발하며 탁하게 만듦.
|
상 동 |
| 탁 도 |
0.5NTU이하 |
비탁법 |
지표면 부식에의한 토양입자가 자연수 부유물질의 대부분을 차지.
탁도가 높은물은 소독효과가 적어서 염소요구량이 증가하며 배수시스템내의 세균번식을 유 발 .
|
점토, 콜로이드입자,
미생물입자에 의해 주로 발생. |
미생물학적 영향 때문에 저탁도 가 추천됨. |
응집침전
여과. |
황산이온
(SO42-) |
200㎎/ℓ
이하 |
적정법
(이온크로마토그라피법(I.C)) |
황산염은 자연적으로 황산바 륨(BaSO4), 엡솜사리염(MgSO 4․7H2O), 석고(CaSO4․2H2 O)등을 포함하는 수 많은 광물 에 존재하므로 지각층에 널리 분포.
자연수중의 황산이온은 주로 지질에 기인. |
황산염은 광산, 제련소, 크라프트용지의 펄프와 화학약품, 염료, 유리, 종이, 비누, 섬 유, 항균제, 살충제, 채광, 펄프업등.
황산염을 포함하고 있는 지질. |
황산염은 가장독성이 작은 음이 온중 하나
물에 다량의 황산염이 존재하면 불쾌한 맛을 냄.
먹는물의 황산염농도가 600㎎/ ℓ이상일 때 쉽게 설사를 일으키므로 장기 음용은 안됨. |
역삼투압법․이온교환수 지법 |
알루미늄
(Al) |
0.2㎎/ℓ
이하 |
흡광광도법
(옥신법) |
토양,식물,동물조직의 구성성분 으로 지질내 풍부한 원소.
가정용, 산업용으로 많이 이용 되고 수처리과정중 응집제 역 할을 함. |
토양,바위로부터 침출 되어 자연수중에 많이 존재.
수처리시 응집제로 인해 처리수의 잔류알루미늄이 있음.
차잎에 많이 함유되어 있고, 방부제, 유화제 등의 식품 첨가제에도 들어감.
|
투석치매, 파킨슨치매와 관련있고, 알츠하이머병의 유발인자로 의심되고 있음. |
이온교환수 지법. |