산화, 환원 , 기준전위 , 용액내에서의 ORP등 ORP 관련 질문 사항들
ORP는 산화 환원전위를 말하는 것으로 화학종의 산화, 환원의 능력을 경향성 있게 알 수 있으며 millivolt 값으로 측정된다.
산화
산화는 원자, 분자 혹은 이온이 전자를 잃게되는 현상을 말한다. 산소와의 결합을 일컫기도 한다.
예를들면 철이 부식되는 현상과 나무가 타는현상 같은 것들이다.
물질이 산화되면 산화수가 증가한다. 많은 물질들이 여러 산화상태로 존재할 수 있다.
좋은예로 황을 들 수 있다. (H2S : -2, S : 0, SO2 : +4, SO42- : +6)
여러 산화상태를 갖는 물질들은 보다 높은 산화상태로 단계별로 산화된다. 다음의 반응에서 Fe2+/Fe 쌍을 산화-환원쌍 (redox couple)이라 한다.
Fe = Fe2+ + 2e-
위의 화학식을 산화의 반쪽반응 (half-reaction)이라 부른다. 철에서 나온 전자는 용액내에 존재할 수 없고 용액내의 다른 물질이 받아들여야 하기 때문이다.
따라서 완전한 반응식에서는 산화와 환원이 동시에 일어나야 한다.
환원
환원은 원자, 분자, 이온들이 전자를 얻는 현상을 말한다.
산화의 경우와 마찬가지로 여러 가지 산화상태를 갖는 물질은 단계적으로 환원되어 낮은 산화상태가 된다.
아래의 식은 chlorine의 환원반쪽 반응이다.
Cl2 (chlorine) + 2e- (electrons) = 2Cl- (chloride ion)
위의 경우에 redox couple은 Cl2/Cl- (chlorine/chloride)이다. 산화반응은 언제나 환원반응과 함께 일어나다.
두 개의 반쪽반응이 결합되어 하나의 전체반응이 될 때 산화반응에서 잃어 버린 전자의 수는 환원반응에서 얻어진 전자의 수와 같아야 한다.
산화 반쪽식 : Fe = Fe2+ + 2e-
환원 반쪽식 : Cl2 + 2e- = 2Cl-
전체반응식 : Fe + Cl2 = FeCl2
위의 반응식에서 chlorine(Cl2)을 환원시키는 철(Fe)을 환원제라 부른다. 반대로 철(Fe)을 산화시키는 chlorine(Cl2)은 산화제라 부른다.
기준전위
어떤 물질이 얼마나 산화 혹은 환원이 잘 되는지는 redox couple의 기준전위에 의해서 알 수 있으며 Eo로 나타낸다.
여러 가지 redox couple의 기준전위값들은 반쪽반응식과 함께 문헌상에 표로 나타나있다.
모든 반응들은 수소이온/수소 (H+/H2) redox couple를 기준으로 하며 이것의 기준전위는 0이다.
반쪽반응의 기준전위는 환원반응으로 사용한다. 표에서 음수로 나타나는 기준전위는 산화반쪽 반응을 나타낸다.
용액내에서의 ORP
반쪽반응에 대한 기준전위는 반응에 참여하는 모든 물질의 농도가 1M 이라는 전제를 하고 있다.
그러나 실제상황에서는 각각의 농도들이 다를 수가 있기 때문에 각각의 경우에 대해서 ORP값을 구하기 위해서는 네른스트 방정식 (Nernst equation)을
사용해야 한다.
ORP 측정에서 네른스트 방정식의 이용
일반적인 반쪽반응의 ORP 값은 다음과 같이 몰농도의 항으로 표시될 수 있다.
aA + bB + cC + ...... + ne-
= xX + yY + zZ + .....
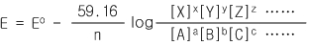
Hypochlorous acid (물속에서의 chlorine)는 네른스트 방정식의 좋은 예가된다.
반쪽반응 HOCl + H+ +2e- → Cl- + H2O
Eo = 1,490mV
25℃에서 네른스트방정식은 다음과 같다.

Hypochlorous acid/chloride 사이의 방정식을 살펴보면 ORP의 중요한 특성을 알 수 있다.
1) ORP는 물을 제외한 반쪽반응에 관여하는 모든 물질의 농도에 영향을 받는다.
2) ORP는 농도비의 log값의 함수이다.
3) ORP 측정에 온도는 매우 다양한 방법으로 영향을 준다. 따라서 일반적인 특징을 발견하기 힘들기 때문에 ORP 측정에서는 대부분 온도보상을 하지 않는다.
ORP 전극
ORP 측정에서는 백금이나 금과 같이 비활성 금속전극을 사용한다. 보편적으로 ORP 측정의 정확도는 ±5mV이다.
때때로 ORP 전극과 어떤 화학종간의 전자교환의 속도가 매우 낮으면 측정에 방해를 받을 수 있다.
이런 경우에는 용액내의 용존산소와 같은 2차 redox couple에 좀더 많이 감응할 수 있어서 오차를 유발하게 된다.
기준전극
보통의 경우 ORP 측정에 사용되는 기준전극은 pH 측정에 사용되는 Ag/AgCl 전극과 동일하다.
표백공정과 같은 경우에는 은조각 (silver billet)이나 심지어는 pH 전극을 기준전극으로 사용하기도 한다.
ORP를 이용한 농도측정
ORP는 물속의 chlorine 측정의 경우와 같이 관련된 모든 인자들을 정확히 이해하고 있지 않더라도 종종 농도측정에 적용된다.
Hypochlorous 용액의 ORP 측정에서 사용되는 방정식을 생각해보면 농도측정과 관련되어 어떠한 문제점이 있는지 개략적으로 살펴볼 수 있다.
ORP는 hypochlorous acid (물속에 녹아있는 chlorine) 뿐만 아니라 Cl- 이온과 H+ 이온에 영향을 받는다.
Cl- 이온과 H+ 이온의 변화는 ORP에 영향을 줄 수 있다.
따라서 chlorine을 정확하게 측정하려면 Cl- 이온과 pH가 매우 정확하게 측정되거나 일정한 값이 되도록 관리되어야 한다.
일반적으로 ORP는 농도측정에 적용하기에 좋은 방법은 아니다. 실제로 모든 ORP 반쪽반응에는 하나 이상의 물질을 포함하며 대부분 pH의 영향을 받는다.
ORP의 응용
ORP는 여러 가지 화학종에 영향을 받기 때문에 응용에 어려움을 겪을 수도 있다.
특별한 목적으로 ORP를 측정하려면 관계를 맺고 있는 반쪽반응에 참여하는 모든 물질의 농도범위를 알아야한다.
또한 ORP의 예측을 위해서는 네른스트 방정식을 이용하여야 한다.
ORP를 모니터링하거나 산화-환원 반응을 조절하는 응용분야에는 다음과 같은 것들이 있다.
Cyanide 분해, 염소제거, 크롬산염 (chromate) 환원, 하이포아염소산염 (hypochlorite)이 관련된 표백공정등이 있다.
위에서 살펴본 바와 같이 ORP를 이용한 농도측정에는 문제점이 있지만 산화제, 환원제를 검출하므로써 누수탐지등에도 응용이 가능하다.
'수질관련용어' 카테고리의 다른 글
| pH 센서가 오염 되었을때 세척방법은? (0) | 2022.11.11 |
|---|---|
| 유리막 pH 센서의 임피던스 및 버퍼교정의 오차 (0) | 2022.11.11 |
| 이온의 농도가 극히 적은 순수의 pH측정은 대단히 어려우며 그 이유는 (0) | 2022.11.11 |
| 망간 제거법에 대해서 (0) | 2022.11.11 |
| Ground Loop로 인해 발생할 수 있는 현상 및 확인방법 그리고 해결책에 대한 내용을 소개 (0) | 2022.11.11 |